Нобелівську премію з медицини отримують Вільям Г. Кейлін-молодший, сер Пітер Дж. Реткліфф і Грегг Л. Семенза
Нобелівську премію з медицини отримують Вільям Г. Кейлін-молодший, сер Пітер Дж. Реткліфф і Грегг Л. Семенза
16 січня 2024, 12:20

Нобелівська асамблея Каролінського інституту сьогодні вирішила присудити Нобелівську премію 2019 року з фізіології та медицини Вільяму Г. Кейліну молодшому, серу Пітеру Дж. Реткліффу та Греггу Л. Семенці за їхні відкриття того, як клітини сприймають і адаптуються до наявності кисню. .
Кисень необхідний тваринам для перетворення їжі в корисну енергію. Фундаментальна важливість кисню була зрозуміла протягом століть, але те, як клітини адаптуються до змін рівня кисню, довгий час було невідомо. Вільям Г. Келін молодший, сер Пітер Дж. Реткліфф і Грегг Л. Семенза виявили, як клітини можуть відчувати зміну наявності кисню та адаптуватися до неї. Вони ідентифікували молекулярний механізм, який регулює активність генів у відповідь на різні рівні кисню.
Фундаментальні відкриття цьогорічних лауреатів Нобелівської премії розкрили механізм одного з найважливіших процесів адаптації в житті. Вони створили основу для нашого розуміння того, як рівень кисню впливає на клітинний метаболізм і фізіологічні функції. Їхні відкриття також проклали шлях для перспективних нових стратегій боротьби з анемією, раком та багатьма іншими захворюваннями.
Кисень з формулою O2 становить близько однієї п'ятої атмосфери Землі. Кисень необхідний для життя тварин: він використовується мітохондріями, присутніми практично в усіх клітинах тварин, для перетворення їжі в корисну енергію. Отто Варбург, лауреат Нобелівської премії з фізіології та медицини 1931 року, виявив, що це перетворення є ферментативним процесом.
В ході еволюції виробилися механізми, що забезпечують достатнє постачання тканин і клітин киснем. Сонне тіло, розташоване поруч із великими кровоносними судинами по обидва боки шиї, містить спеціалізовані клітини, які сприймають рівень кисню в крові. Нобелівська премія з фізіології та медицини 1938 року Корнелю Хеймансу була присуджена за відкриття, які показують, як відчуття кисню в крові через сонну артерію контролює частоту дихання шляхом прямого зв’язку з мозком.
На додаток до швидкої адаптації каротидного тіла до низького рівня кисню (гіпоксія), що контролюється каротидним тілом, існують інші фундаментальні фізіологічні адаптації. Ключовою фізіологічною реакцією на гіпоксію є підвищення рівня гормону еритропоетину (ЕРО), що призводить до збільшення виробництва еритроцитів (еритропоезу). Важливість гормонального контролю еритропоезу була відома ще на початку 20-го століття, але як саме цей процес контролювався O2 залишалося загадкою.
Грегг Семенза вивчав ген EPO і те, як він регулюється різними рівнями кисню. Використовуючи геномодифікованих мишей, було показано, що специфічні сегменти ДНК, розташовані поруч з геном EPO, опосередковують відповідь на гіпоксію. Сер Пітер Реткліфф також вивчав O2 -залежну регуляцію гена EPO, і обидві дослідницькі групи виявили, що механізм сприйняття кисню присутній практично в усіх тканинах, а не лише в клітинах нирок, де зазвичай виробляється EPO. Це були важливі відкриття, які показали, що механізм був загальним і функціональним у багатьох різних типах клітин.
Семенза хотів ідентифікувати клітинні компоненти, що опосередковують цю відповідь. У культивованих клітинах печінки він виявив білковий комплекс, який зв’язується з ідентифікованим сегментом ДНК залежним від кисню способом. Він назвав цей комплекс фактором, викликаним гіпоксією (HIF). Почалися значні зусилля з очищення комплексу HIF, і в 1995 році Семенза зміг опублікувати деякі зі своїх ключових висновків, включаючи ідентифікацію генів, що кодують HIF. Було виявлено, що HIF складається з двох різних ДНК-зв’язуючих білків, так званих факторів транскрипції, які тепер називаються HIF-1α та ARNT. Тепер дослідники можуть почати розгадувати головоломку, що дозволить їм зрозуміти, які додаткові компоненти були задіяні та як працює машина.
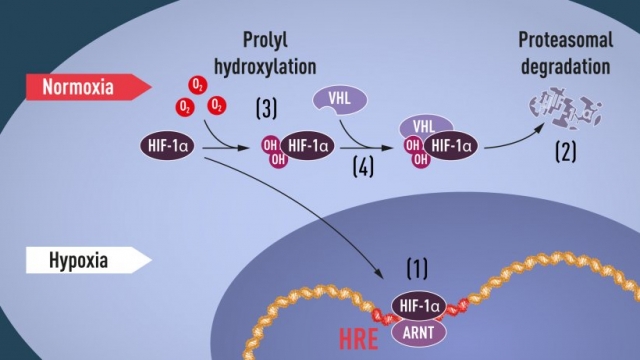
Коли рівень кисню високий, клітини містять дуже мало HIF-1α. Однак, коли рівень кисню низький, кількість HIF-1α збільшується, щоб він міг зв’язуватися з геном EPO та регулювати його, а також іншими генами з HIF-зв’язуючими сегментами ДНК. Кілька дослідницьких груп показали, що HIF-1α, який зазвичай швидко руйнується, захищений від руйнування в умовах гіпоксії. За нормального рівня кисню клітинна машина під назвою протеасома, визнана Нобелівською премією з хімії 2004 року Аарону Сіхановеру, Авраму Гершко та Ірвіну Роузу, розщеплює HIF-1α. За таких умов невеликий пептид, убіквітин, додається до білка HIF-1α. Убіквітин функціонує як мітка для білків, призначених для деградації в протеасомі. Як убіквітин зв'язується з HIF-1α залежно від кисню, залишалося центральним питанням.
Відповідь прийшла з несподіваного боку. Приблизно в той самий час, коли Семенза та Реткліфф досліджували регуляцію гена EPO, дослідник раку Вільям Кейлін-молодший досліджував спадковий синдром, хворобу фон Гіппеля-Ліндау (хвороба VHL). Це генетичне захворювання призводить до різко підвищеного ризику деяких видів раку в сім’ях із успадкованими мутаціями VHL. Келін показав, що ген VHL кодує білок, який запобігає виникненню раку. Келін також показав, що ракові клітини, у яких відсутній функціональний ген VHL, експресують аномально високі рівні генів, регульованих гіпоксією; але коли ген VHL було повторно введено в ракові клітини, нормальні рівні були відновлені. Це була важлива підказка, яка показує, що VHL якимось чином бере участь у контролі відповідей на гіпоксію. Додаткові підказки надійшли від кількох дослідницьких груп, які показують, що VHL є частиною комплексу, який маркує білки убіквітином, позначаючи їх для деградації в протеасомі. Тоді Реткліфф і його дослідницька група зробили ключове відкриття: продемонстрували, що VHL може фізично взаємодіяти з HIF-1α і необхідний для його деградації при нормальному рівні кисню. Це остаточно пов'язало VHL з HIF-1α.
Багато частин стало на свої місця, але все ще бракувало розуміння того, як рівні O2 регулюють взаємодію між VHL і HIF-1α. Пошук був зосереджений на певній частині білка HIF-1α, який, як відомо, важливий для VHL-залежної деградації, і Келін, і Реткліфф підозрювали, що ключ до визначення O2 знаходиться десь у цьому білковому домені. У 2001 році в двох одночасно опублікованих статтях вони показали, що за нормального рівня кисню гідроксильні групи додаються у двох конкретних положеннях у HIF-1α (рис. 1). Ця модифікація білка, яка називається пролілгідроксилюванням, дозволяє VHL розпізнавати та зв’язуватися з HIF-1α і таким чином пояснює, як нормальний рівень кисню контролює швидку деградацію HIF-1α за допомогою чутливих до кисню ферментів (так званих пролілгідроксилаз). Подальші дослідження Реткліффа та інших виявили відповідальні пролілгідроксилази. Було також показано, що функція активації гена HIF-1α регулюється кисневозалежним гідроксилюванням. Лауреати Нобелівської премії з’ясували механізм визначення кисню та показали, як він працює.
Завдяки новаторській роботі цих Нобелівських лауреатів ми знаємо набагато більше про те, як різні рівні кисню регулюють фундаментальні фізіологічні процеси. Розпізнавання кисню дозволяє клітинам адаптувати свій метаболізм до низького рівня кисню: наприклад, у наших м’язах під час інтенсивних тренувань. Інші приклади адаптивних процесів, контрольованих датчиком кисню, включають утворення нових кровоносних судин і виробництво еритроцитів. Наша імунна система та багато інших фізіологічних функцій також точно налаштовані механізмом, що сприймає O2 . Було навіть показано, що датчик кисню є важливим під час внутрішньоутробного розвитку для контролю нормального формування кровоносних судин і розвитку плаценти.
Зондування кисню є центральним у багатьох захворюваннях. Наприклад, пацієнти з хронічною нирковою недостатністю часто страждають від важкої анемії через зниження експресії EPO. EPO виробляється клітинами в нирках і необхідний для контролю утворення еритроцитів, як пояснювалося вище. Крім того, апарат, що регулює кисень, відіграє важливу роль у розвитку раку. У пухлинах апарат, який регулюється киснем, використовується для стимуляції утворення кровоносних судин і зміни метаболізму для ефективної проліферації ракових клітин. Постійні інтенсивні зусилля в академічних лабораторіях і фармацевтичних компаніях зараз зосереджені на розробці ліків, які можуть впливати на різні хворобливі стани шляхом активації або блокування механізму визначення кисню.









