Нобелівську премію з фізіології та медицини 2023 року спільно присудили Каталін Каріко та Дрю Вайсману «за відкриття щодо модифікацій нуклеозидних основ, які дозволили розробити ефективні мРНК-вакцини проти COVID-19».
Нобелівську премію з фізіології та медицини 2023 року спільно присудили Каталін Каріко та Дрю Вайсману «за відкриття щодо модифікацій нуклеозидних основ, які дозволили розробити ефективні мРНК-вакцини проти COVID-19».
15 лютого 2024 року


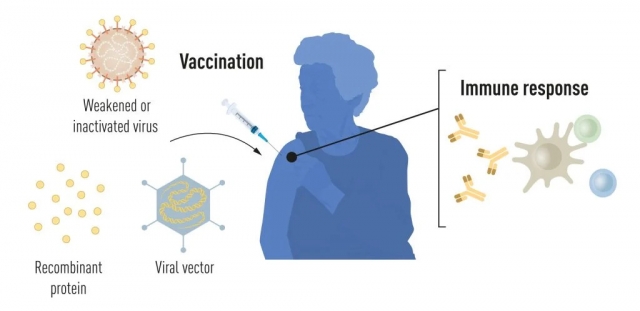
Вакцинація стимулює формування імунної відповіді на певний збудник. Це дає організму фору в боротьбі з хворобою у разі подальшого опромінення. Вакцини на основі вбитих або ослаблених вірусів вже давно доступні, прикладами яких є вакцини проти поліомієліту, кору та жовтої лихоманки. У 1951 році Макс Тейлер був удостоєний Нобелівської премії з фізіології та медицини за розробку вакцини проти жовтої лихоманки.
Завдяки прогресу в молекулярній біології за останні десятиліття були розроблені вакцини на основі окремих вірусних компонентів, а не цілих вірусів. Частини генетичного коду вірусу, які зазвичай кодують білки, що знаходяться на поверхні вірусу, використовуються для створення білків, які стимулюють утворення антитіл, що блокують вірус. Прикладами є вакцини проти вірусу гепатиту В і вірусу папіломи людини. Крім того, частини генетичного коду вірусу можна перенести на нешкідливий вірус-носій, «вектор». Цей метод використовується у вакцинах проти вірусу Ебола. Коли векторні вакцини вводяться, вибраний вірусний білок виробляється в наших клітинах, стимулюючи імунну відповідь проти цільового вірусу.
Виробництво цільновірусних, білкових і векторних вакцин вимагає великомасштабної культури клітин. Цей ресурсномісткий процес обмежує можливості швидкого виробництва вакцин у відповідь на спалахи та пандемії. Тому дослідники вже давно намагаються розробити технології вакцин, незалежні від культури клітин, але це виявилося складним завданням.
У наших клітинах генетична інформація, закодована в ДНК, передається на інформаційну РНК (мРНК), яка використовується як шаблон для виробництва білка. У 1980-х роках були запроваджені ефективні методи отримання мРНК без культури клітин, які називаються транскрипцією in vitro. Цей вирішальний крок прискорив розвиток застосувань молекулярної біології в кількох галузях. Ідеї використання технологій мРНК для вакцин і терапевтичних цілей також отримали популярність, але попереду були перешкоди. Транскрибовану in vitro мРНК вважали нестабільною та важкою для доставки, що вимагало розробки складних ліпідних систем носіїв для інкапсуляції мРНК. Крім того, отримана in vitro мРНК викликала запальні реакції. Тому ентузіазм щодо розробки технології мРНК для клінічних цілей спочатку був обмеженим.
Ці перешкоди не збентежили угорського біохіміка Каталін Каріко, яка була віддана розробці методів використання мРНК для терапії. На початку 1990-х років, коли вона була доцентом в Університеті Пенсильванії, вона залишалася вірною своєму баченню реалізації мРНК як терапевтичного засобу, незважаючи на труднощі в переконанні спонсорів дослідження у важливості свого проекту. Новим колегою Каріко в її університеті став імунолог Дрю Вайсман. Його цікавили дендритні клітини, які відіграють важливу функцію в імунному нагляді та активації імунної відповіді, викликаної вакциною. Підштовхнуте новими ідеями, незабаром почалася плідна співпраця між ними, зосереджуючись на тому, як різні типи РНК взаємодіють з імунною системою.
Каріко та Вайсман помітили, що дендритні клітини розпізнають транскрибовану in vitro мРНК як чужорідну речовину, що призводить до їх активації та вивільнення запальних сигнальних молекул. Вони дивувалися, чому транскрибована in vitro мРНК була визнана чужорідною, тоді як мРНК із клітин ссавців не викликала такої ж реакції. Каріко і Вайсман зрозуміли, що різні типи мРНК повинні відрізнятися за деякими критичними властивостями.
РНК містить чотири основи, скорочено A, U, G і C, що відповідають A, T, G і C в ДНК, буквам генетичного коду. Каріко та Вайсман знали, що основи в РНК клітин ссавців часто хімічно модифіковані, тоді як мРНК, транскрибована in vitro, ні. Вони задавалися питанням, чи може відсутність змінених основ у транскрибованій in vitro РНК пояснити небажану запальну реакцію. Щоб дослідити це, вони створили різні варіанти мРНК, кожна з яких мала унікальні хімічні зміни в своїх основах, які вони доставили до дендритних клітин. Результати були вражаючими: запальна відповідь була майже скасована, коли модифікації основи були включені в мРНК. Це була зміна парадигми в нашому розумінні того, як клітини розпізнають і реагують на різні форми мРНК. Каріко та Вайсман одразу зрозуміли, що їх відкриття має величезне значення для використання мРНК як терапії. Ці основоположні результати були опубліковані в 2005 році, за п’ятнадцять років до пандемії COVID-19.
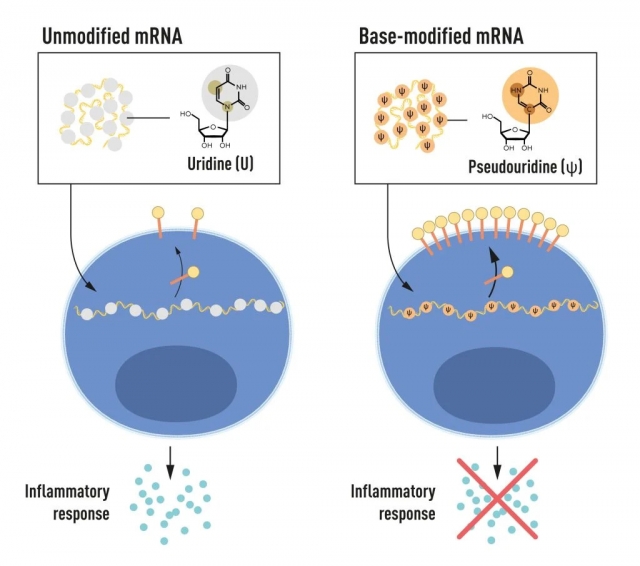
У подальших дослідженнях, опублікованих у 2008 та 2010 роках, Каріко та Вайсман показали, що доставка мРНК, створеної за допомогою модифікації основи, помітно збільшує виробництво білка порівняно з немодифікованою мРНК. Ефект був обумовлений зниженою активацією ферменту, який регулює виробництво білка. Завдяки своїм відкриттям про те, що модифікації основ зменшують запальні реакції та збільшують виробництво білка, Каріко та Вайсман усунули критичні перешкоди на шляху до клінічного застосування мРНК.
Вражаюча гнучкість і швидкість, з якою можна розробляти мРНК-вакцини, прокладають шлях до використання нової платформи також для вакцин проти інших інфекційних захворювань. У майбутньому ця технологія також може бути використана для доставки терапевтичних білків і лікування деяких типів раку.
Також було швидко впроваджено кілька інших вакцин проти SARS-CoV-2, заснованих на різних методологіях, і разом у всьому світі було введено понад 13 мільярдів доз вакцини проти COVID-19. Вакцини врятували мільйони життів і запобігли важким захворюванням у багатьох інших, дозволивши суспільствам відкритися та повернутися до нормальних умов. Завдяки фундаментальним відкриттям важливості модифікацій основ мРНК цьогорічні лауреати Нобелівської премії зробили значний внесок у цей трансформаційний розвиток під час однієї з найбільших криз охорони здоров’я нашого часу.









